جدول مندلیف چیست و چه کاربردی دارد؟
جدول مندلیف نه تنها ابزاری برای دستهبندی عناصر است، بلکه به عنوان یک راهنمای جامع برای درک اصول شیمی و کاربردهای آن در زندگی روزمره و فناوری عمل میکند.

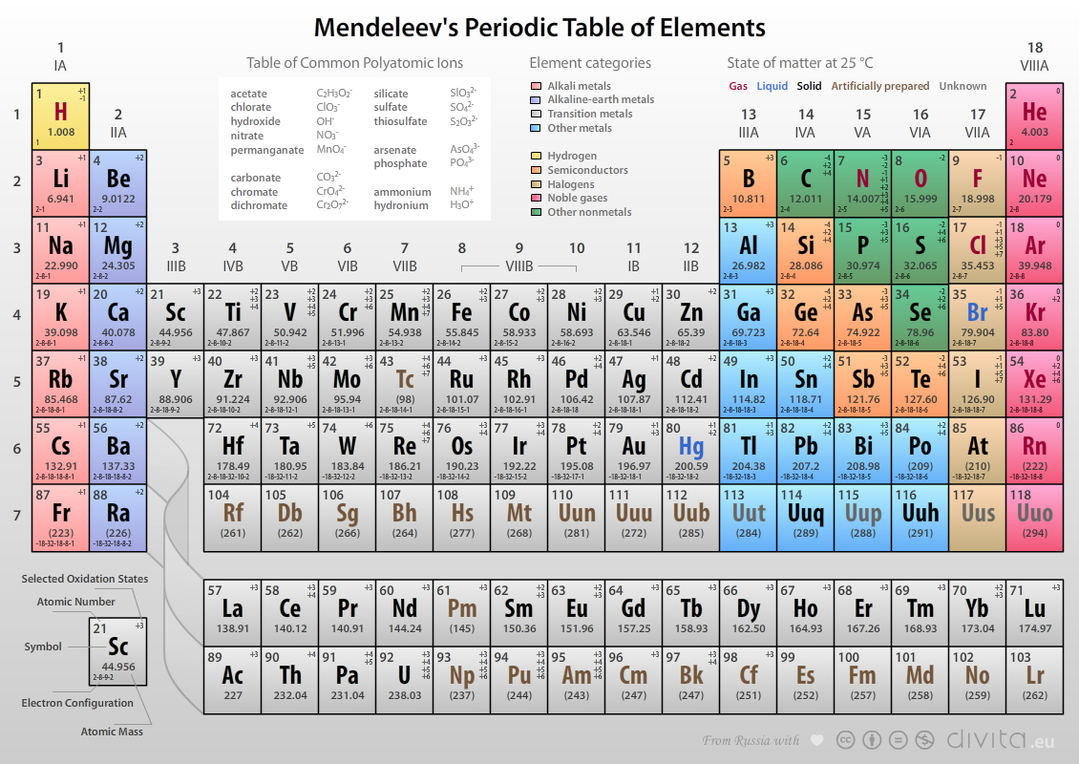
جامعه ۲۴- جدول مندلیف یا جدول تناوبی عناصر، یک آرایش منظم و ساختار یافته از عناصر شیمیایی است که بر اساس عدد اتمی (تعداد پروتونها در هسته اتم)، پیکربندی الکترونی و خواص شیمیایی تکرارشونده تنظیم شده است. این جدول نخستین بار در سال ۱۸۶۹ توسط شیمیدان روسی، دمیتری مندلیف، ارائه شد.
ساختار جدول مندلیف
۱. دورهها (ردیفها):
جدول شامل ۷ دوره است که هر کدام نشاندهنده تعداد لایههای الکترونی اتم عناصر آن دوره است. به عنوان مثال، عناصر دوره اول تنها یک لایه الکترونی دارند.
۲. گروهها (ستونها):
جدول شامل ۱۸ گروه است که عناصر هر گروه خواص شیمیایی مشابه دارند. به عنوان مثال، عناصر گروه ۱ (فلزات قلیایی) همگی بسیار واکنشپذیر هستند.
۳. بلوکها:
عناصر به چهار بلوک (s، p، d، f) تقسیم میشوند که به پیکربندی الکترونی آنها مرتبط است.
۴. عناصر فلزی و نافلزی:
فلزات: عمدتاً در سمت چپ و مرکز جدول قرار دارند.
نافلزات: در سمت راست جدول قرار دارند.
متالوئیدها: در مرز بین فلزات و نافلزات واقع شدهاند و خواص هر دو را دارند.
اهمیت جدول مندلیف
پیشبینی خواص عناصر ناشناخته: مندلیف موفق شد خواص عناصر ناشناخته زمان خود را پیشبینی کند که بعداً کشف شدند.
ارتباط بین خواص فیزیکی و شیمیایی عناصر: جدول نشاندهنده شباهتها و تفاوتهای عناصر در یک الگوی منظم است.
امروزه جدول مندلیف با کشف عناصر جدید و اطلاعات دقیقتر بهروزرسانی شده و به عنوان یک ابزار بنیادی در شیمی مورد استفاده قرار میگیرد.
مخترع جدول مندلیف کیست؟
دمیتری ایوانویچ مندلیف (۱۸۳۴-۱۹۰۷)
دمیتری مندلیف یک شیمیدان و دانشمند روس بود که به خاطر اختراع جدول تناوبی عناصر شهرت جهانی یافت. او با کشف الگوی تکرار شونده خواص عناصر، نقش مهمی در پیشرفت علم شیمی ایفا کرد.
زندگینامه:
تولد و دوران کودکی:
تاریخ تولد: ۸ فوریه ۱۸۳۴ (۲۸ ژانویه به تقویم ژولینی)
محل تولد: توبولسک، سیبری، روسیه
مندلیف آخرین فرزند از خانوادهای پرجمعیت (۱۴ فرزند) بود.
پدرش، ایوان پاولویچ، مدیر یک مدرسه محلی بود و زمانی که دمیتری کودک بود، بینایی خود را از دست داد و اندکی بعد فوت کرد. مادرش برای تامین معاش خانواده تلاش زیادی کرد.
تحصیلات:
در جوانی وارد موسسه تربیت معلمان در سن پترزبورگ شد و علاقه زیادی به علم نشان داد.
او در سال ۱۸۵۵ مدرک خود را در رشته علوم دریافت کرد.
بیشتر بخوانید: سال نوری چیست؟/ آیا انسان قادر به رسیدن به سرعت نور است؟
فعالیتهای علمی:
مندلیف در دهه ۱۸۶۰ به تدریس شیمی در دانشگاه سن پترزبورگ پرداخت.
در سال ۱۸۶۹، مهمترین کار خود یعنی جدول تناوبی عناصر را ارائه داد. او متوجه شد که خواص شیمیایی عناصر به صورت دورهای با افزایش عدد اتمی تکرار میشوند.
او به طرز شگفتانگیزی توانست خواص و وجود عناصری را که هنوز کشف نشده بودند پیشبینی کند. برای مثال، عناصر ژرمانیم، گالیوم و اسکاندیم که بعدها کشف شدند، خواصی مطابق پیشبینیهای مندلیف داشتند.
سایر دستاوردها:
مطالعات در زمینه وزن اتمی عناصر
تحقیق در زمینههای مختلف علمی از جمله فیزیک، هواشناسی و کشاورزی
ابداع روشهای جدید برای اندازهگیری چگالی گازها
افتخارات:
در سال ۱۹۰۶ برای جایزه نوبل شیمی نامزد شد، اما به دلیل مخالفتهای شخصی، این جایزه به او داده نشد.
درگذشت:
دمیتری مندلیف در ۲ فوریه ۱۹۰۷ در سن پترزبورگ درگذشت.
میراث مندلیف
مندلیف نه تنها به عنوان مخترع جدول تناوبی شناخته میشود، بلکه به دلیل پیشرفتهای اساسی در علم شیمی، به یکی از بزرگترین دانشمندان تاریخ تبدیل شده است. جدول او همچنان یکی از ابزارهای بنیادی در علوم شیمی و فیزیک محسوب میشود.
کاربرد جدول مندلیف چیست؟
کاربردهای جدول مندلیف (جدول تناوبی عناصر):
جدول مندلیف به عنوان یکی از مهمترین ابزارهای علم شیمی، کاربردهای گستردهای در زمینههای مختلف علمی و صنعتی دارد. در زیر به برخی از کاربردهای اصلی آن اشاره میکنیم:
۱. پیشبینی خواص عناصر و ترکیبات:
جدول مندلیف به شیمیدانان کمک میکند تا خواص فیزیکی و شیمیایی عناصر را بر اساس جایگاه آنها در جدول پیشبینی کنند.
به عنوان مثال، میتوان واکنشپذیری یک عنصر، نقطه ذوب، نقطه جوش و حتی نوع پیوندهایی که تشکیل میدهد را حدس زد.
۲. طبقهبندی عناصر:
این جدول عناصر را بر اساس شباهتهای شیمیایی و فیزیکی دستهبندی کرده است.
به عنوان مثال، فلزات قلیایی (گروه ۱) همگی واکنشپذیرند و با آب تولید هیدروژن میکنند.
۳. کشف عناصر جدید:
جدول تناوبی برای پیشبینی وجود عناصر ناشناخته و خواص آنها استفاده میشود.
عناصر جدیدی که کشف شدهاند، مانند ژرمانیم، گالیوم و نوبلیم، همگی با پیشبینیهای مندلیف مطابقت داشتند.
۴. مطالعه واکنشهای شیمیایی:
جدول به شیمیدانان کمک میکند تا واکنشهای بین عناصر مختلف را بررسی و پیشبینی کنند.
به عنوان مثال، میتوان پیشبینی کرد که فلزات قلیایی (گروه ۱) با هالوژنها (گروه ۱۷) به شدت واکنش میدهند و نمکها را تشکیل میدهند.
۵. درک ساختار اتمی:
جدول اطلاعاتی درباره ساختار الکترونی عناصر ارائه میدهد.
از طریق جایگاه عناصر، میتوان تعداد لایههای الکترونی و تعداد الکترونهای ظرفیت یک عنصر را شناسایی کرد.
۶. کاربرد در صنعت و فناوری:
جدول تناوبی در صنایع مختلف مانند الکترونیک، متالورژی، داروسازی و کشاورزی استفاده میشود.
در الکترونیک: عناصر مانند سیلیسیم (Si) و ژرمانیم (Ge) در ساخت نیمههادیها استفاده میشوند.
در پزشکی: عناصر رادیواکتیو مانند ید-۱۳۱ برای درمان سرطان و تیروئید به کار میروند.
در کشاورزی: عناصر مانند نیتروژن (N)، فسفر (P) و پتاسیم (K) در کودهای شیمیایی استفاده میشوند.
۷. آموزش و تحقیق:
جدول تناوبی یک ابزار آموزشی حیاتی در علم شیمی است و در درک اصول پایهای شیمی برای دانشجویان و پژوهشگران استفاده میشود.
۸. مطالعه روندهای تناوبی:
جدول تناوبی برای تحلیل روندهایی مانند اندازه اتم، انرژی یونیزاسیون، الکترونگاتیویته و شعاع یونی استفاده میشود. این روندها برای پیشبینی رفتار شیمیایی عناصر مفیدند.
جدول مندلیف نه تنها ابزاری برای دستهبندی عناصر است، بلکه به عنوان یک راهنمای جامع برای درک اصول شیمی و کاربردهای آن در زندگی روزمره و فناوری عمل میکند.
جدول مندلیف (جدول تناوبی عناصر) یکی از شگفتانگیزترین ابداعات علمی است که ساختار و الگوی رفتار عناصر شیمیایی را به صورت منظم و قانونمند نشان میدهد. در اینجا مطالب بیشتری درباره تاریخچه، ویژگیها، روندهای تناوبی و جزئیات پیشرفته آن ارائه شده است:
تاریخچه و تکامل جدول مندلیف
۱. پیش از مندلیف:
پیش از مندلیف، دانشمندان تلاشهایی برای دستهبندی عناصر داشتند:
یوهان ولفگانگ دوبراینر (۱۸۱۷): قانون سهتاییها؛ او گروههای کوچک از عناصر مشابه مانند کلر، برم و ید را شناسایی کرد.
جان نیولندز (۱۸۶۴): قانون اکتاوها؛ او گفت که هر هشتمین عنصر خواص مشابهی دارد، اما ایدهاش به دلیل نواقص جدی رد شد.
۲. مندلیف (۱۸۶۹):
دمیتری مندلیف جدول خود را بر اساس وزن اتمی (جرم اتمی) تنظیم کرد.
او متوجه الگوی تکرارشونده خواص عناصر شد و این الگو را به صورت دورهای در جدول نشان داد.
یکی از شاهکارهای او این بود که جای خالی برای عناصر ناشناخته مانند گالیوم، ژرمانیم و اسکاندیم باقی گذاشت و خواص آنها را دقیقاً پیشبینی کرد.
۳. تکامل جدول:
هنری موزلی (۱۹۱۳): اصلاح جدول مندلیف بر اساس عدد اتمی به جای وزن اتمی؛ این تغییر جدول را کاملتر و دقیقتر کرد.
گلن تی. سیبورگ (۱۹۴۰): کشف عناصر فرااورانیمی (عناصر با عدد اتمی بالاتر از ۹۲) و افزودن بلوک f به جدول.
ساختار پیشرفته جدول مندلیف:
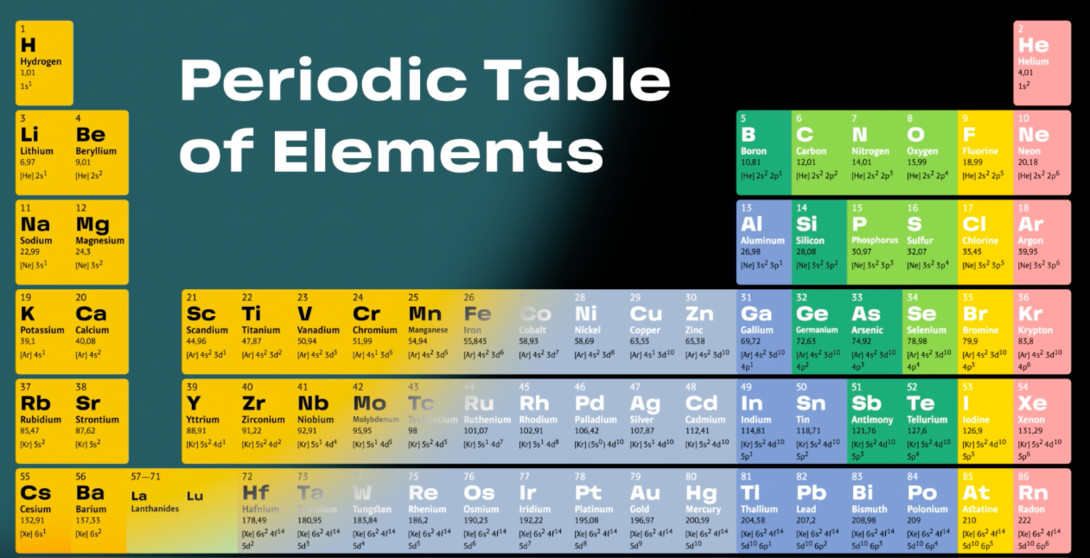
۱. گروهها (ستونها):
۱۸ گروه وجود دارد و عناصر در هر گروه خواص شیمیایی مشابه دارند.
مثال:
گروه ۱ (فلزات قلیایی): سدیم (Na)، پتاسیم (K).
گروه ۱۷ (هالوژنها): کلر (Cl)، فلوئور (F).
گروه ۱۸ (گازهای نجیب): هلیوم (He)، نئون (Ne).
۲. دورهها (ردیفها):
۷ دوره وجود دارد که نشاندهنده تعداد لایههای الکترونی عناصر است.
هر چه عدد دوره بیشتر باشد، اندازه اتم بزرگتر است.
۳. بلوکها:
عناصر به چهار بلوک تقسیم میشوند:
s: فلزات قلیایی و قلیایی خاکی.
p: نافلزات، هالوژنها و گازهای نجیب.
d: فلزات واسطه مانند آهن (Fe)، نیکل (Ni).
f: عناصر لانتانید و اکتینید.
روندهای تناوبی در جدول:
۱. اندازه اتمی:
از چپ به راست در یک دوره کاهش مییابد.
از بالا به پایین در یک گروه افزایش مییابد.
۲. انرژی یونیزاسیون:
از چپ به راست در یک دوره افزایش مییابد.
از بالا به پایین در یک گروه کاهش مییابد.
۳. الکترونگاتیویته:
میزان تمایل اتم برای جذب الکترون.
از چپ به راست افزایش و از بالا به پایین کاهش مییابد.
۴. خواص فلزی و نافلزی:
در سمت چپ جدول (فلزات) بیشتر است.
در سمت راست جدول (نافلزات) بیشتر است.
ویژگیهای جالب جدول مندلیف
۱. پیشبینی دقیق:
مندلیف وجود عناصری مانند گالیوم (Ga)، ژرمانیم (Ge) و اسکاندیم (Sc) را پیشبینی کرد و خواص آنها با کشف واقعی تطابق داشت.
۲. انعطافپذیری:
جدول برای کشف عناصر جدید و اضافه شدن آنها طراحی شده است.
آخرین عنصر کشفشده در جدول، اوگانسون (Og) با عدد اتمی ۱۱۸ است.
۳. استفاده در شیمی کوانتومی:
جدول تناوبی بر اساس پیکربندی الکترونی عناصر و نظریههای مکانیک کوانتومی بهبود یافته است.
کاربردهای پیشرفته جدول مندلیف
۱. طراحی مواد جدید:
ترکیبات پیشرفته مانند نیمههادیها، ابررساناها و آلیاژها با استفاده از جدول طراحی میشوند.
۲. شیمی فضایی:
در بررسی ترکیبات شیمیایی موجود در سیارات دیگر استفاده میشود.
۳. فیزیک هستهای:
مطالعه خواص عناصر رادیواکتیو و سنتز عناصر فوق سنگین.
جدول مندلیف یک ابزار پویا و بنیادین در علوم شیمی، فیزیک و سایر علوم مرتبط است. این جدول نه تنها درک ما از عناصر موجود در طبیعت را گسترش داده، بلکه مسیر کشفهای جدید را هموار کرده است.